肿瘤干细胞(一)
肿瘤干细胞功能
肿瘤干细胞诱导多潜能干细胞 肿瘤干细胞的主要功能
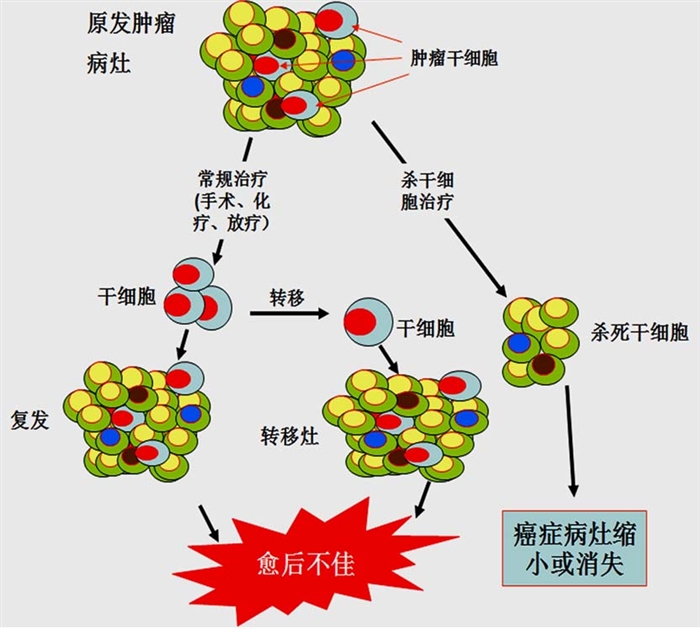
肿瘤干细胞对肿瘤的存活、增值、转移及复发有着重要作用。从本质上讲,肿瘤干细胞通过自我更新和无限增值维持着肿瘤细胞群的生命力;肿瘤干细胞的运动和迁徙能力又使肿瘤细胞的转移成为可能;肿瘤干细胞可以长时间处于休眠状态并具有多种耐药分子而对杀伤肿瘤细胞的外界理化因素不敏感,因此肿瘤往往在常规肿瘤治疗方法消灭大部分普通肿瘤细胞后一段时间复发。
实验依据
从20世纪50年代Southam C.等进行的肿瘤细胞自体/异体移植实验到后来众多实验都证实并非每个肿瘤细胞都有再生肿瘤的能力,只有一小部分肿瘤细胞在体外克隆形成实验中可以形成克隆,在异种移植模型中,只有移植人大量的肿瘤细胞才能形成移植瘤,究竟何种细胞行使肿瘤起源细胞(tumor—initiating cell,T—IC)的功能?目前有两种理论解释,一是随机化理论,它认为肿瘤细胞具有同质性,即每一个肿瘤细胞都具有新生肿瘤的潜力,但是能进入细胞分化周期的肿瘤细胞很少,是一个小概率随机事件。而分层理论认为,肿瘤细胞具有功能异质性,只有有限数目的肿瘤细胞具有产生肿瘤的能力,但这些肿瘤细胞再生肿瘤是高频事件。虽然两种理论都认为只有很少数量的肿瘤细胞能再生肿瘤,但是机制是完全不同的。目前的实验结果倾向于第二种解释,即肿瘤组织中存在数量稀少的癌细胞,在肿瘤形成过程中充当干细胞的角色,具有自我更新、增殖和分化的潜能,虽然数量少,却在肿瘤的发生、发展、复发和转移中起着重要作用,由于其众多性质与干细胞相似,所以这些细胞被称为肿瘤干细胞,肿瘤干细胞能不对称产成两种异质的细胞,一种是与之性质相同的肿瘤干细胞,另一种是组成肿瘤大部分的非致瘤癌细胞。AACRl3 (American As.sociation for Cancer Research)2006年给出的定义是:肿瘤中具有自我更新能力并能产生异质性肿瘤细胞的细胞。 肿瘤启动细胞
(tumor initiating cell,TIC)肿瘤细胞自体同源移植实验表明,移植瘤细胞数大于106个以上,才能形成肿瘤。体外培养骨髓瘤、人肺癌、卵巢癌及神经母细胞瘤细胞也发现,仅极少细胞能形成集落。这些数量极其稀少,却在肿瘤发生中起主要作用的肿瘤细胞亚群,被称为TIC。
血液TSC
急性髓性白血病的研究表明,不同的白血病细胞亚群移植到严重联合免疫缺陷病的裸鼠,其肿瘤细胞成瘤能力差异巨大。占总数0.2%~1%的白血病细胞有稳定持续的形成肿瘤克隆的能力,具备干细胞特性,被称作白血病干细胞。
实体瘤干细胞
少数睾丸癌细胞含有与不成熟胚胎细胞同样的表面标志,提示实体瘤中TSC可能存在。首先证实实体瘤中TSC存在的是在2003年,Clarke的研究小组从乳腺癌中分离出了乳腺癌干细胞。随即,星形细胞瘤、成神经管细胞瘤与胶质母细胞瘤等脑肿瘤干细胞先后分离成功。 早在20世纪60~70年代,许多学者就已找到实体瘤干细胞存在的实验依据:实体瘤细胞存在异质性,只有小部分细胞有克隆形成能力。Hamburger等发现,只有0.02%~0.1%的肺癌、卵巢癌与神经母细胞瘤细胞有能力在体外软琼脂培养基上形成克隆(细胞克隆培养),这与白血病干细胞有很大的相似性,表明其是一种肿瘤干细胞。但是由于当时实验技术等的限制,尚未对其进行分离纯化。
编辑本段
TSC的特性
极强的致瘤能力
TSC数目极其稀少,成瘤能力较普通肿瘤细胞大数百倍以上,是肿瘤发生、发展与维持的基础。
自我更新并多向分化
肿瘤中部分细胞多向分化的现象在临床观察中很早就有发现:前列腺瘤经雄激素治疗后可以变成小细胞癌、鳞癌或者是癌肉瘤;生殖细胞肿瘤也可以转变为非生殖细胞肿瘤的类型,包括肉瘤、癌、神经外胚层肿瘤以及造血组织恶性肿瘤 ;大部分混合瘤中虽然肿瘤细胞有各种不同的组织形态,但却具有遗传同源性,说明它们来源于一个共同的祖细胞;单个大鼠结肠腺瘤细胞注射到小鼠,可生成结肠所有类型细胞,如黏膜细胞、柱状细胞、内分泌细胞和未分化的肿瘤细胞。多发性骨髓瘤中得到的TSC属于B淋巴细胞亚群,能自我更新并分化为浆细胞和肿瘤细胞。乳腺癌细胞与脑肿瘤TSC移植到裸鼠,可以生成原来肿瘤的所有细胞类型,说明TSC具备自我更新与多向分化能力。
TSC与成体干细胞关系
肿瘤细胞突变最早发生于干细胞:干细胞与TSC具有无限增殖相似的生物学特性,只需突变获得过度增殖能力, 就可以转化成为肿瘤;干细胞比分化细胞周期性更新快,寿命长,突变更容易累积。干细胞是突变的靶。
表面标记表明TSC来源于成体干细胞:由于造血干细胞研究进展,白血病干细胞的分离和表面标记测定较早开始。目前研究发现,所有几乎白血病干细胞与造血干细胞一致,均为CD34+ ,如所有的急性单核细胞性白血病(除急性早幼粒细胞性白血病) 干细胞都为
[CD34+, CD38?]。白血病细胞为[CD34+CD38-Thy-1-]。急性髓性白血病细胞频繁发生染色体易位(8;21),形成AML1-ETO嵌合转录物。患者缓解后骨髓中有一部分干细胞仍能合成AML1-ETO融合蛋白,但这部分干细胞及其子代不能诱发白血病,在体外能分化为正常的红细胞系,细胞表面标记也与正常造血干细胞几乎完全一致,为[CD34+CD38-Thy-1+]。说明易位最早发生于正常造血干细胞,突变在造血干细胞的亚群或子代中发生,导致白血病的发生。根据白血病干细胞的标记与正常造血干细胞的不同,突变大约发生于Thy-1的祖细胞或丢失Thy-1的造血干细胞。
其他成体干细胞分离与表面标记研究不够深入,目前难以比较TSC与成体干细胞的表面标记。动物实验发现,乳腺癌干细胞标记CD44+在幼稚细胞、祖细胞或干细胞中都是经常见到的[7];而64位乳腺癌患者的观察证实,大部分患者的肿瘤细胞表型与干细胞表型相同
[CK8+,14+,18+;Vi? mentin+,EGFR+] ;对未成年患者脑肿瘤研究表明,TSC标记CD133、musashi-1、 Sox2、melk、 PSP、 Bmi-1和nestin,与神经干细胞完全一致。
编辑本段
成体干细胞TSC与Bmi1
基因参与正常造血过程,其功能障碍与AML有关。Bmi?1基因敲除的小鼠干细胞移植入免疫力摧毁的小鼠,干细胞可以短期产生血细胞 ,8周后,移植细胞基本消失。说明Bmi?1基因对正常血液干细胞的自我更新是必要的[18,19]。
Bmi1

Bim1基因对白血病细胞的产生也是必要的。Meis1a和Hoxa9癌基因导入小鼠骨髓细胞可以产生AML模型。把Meis1a和Hoxa9癌基因导入正常小鼠与BMI-1基因失活小鼠,都可以产生白血病细胞。但是Bmi-1基因失活小鼠的白血病细胞移植入免疫缺陷小鼠后不能再产生白血病细胞。所以,Bmi-1基因对白血病干细胞的自我更新和维持都是必要的。 干细胞与TSC有相似的生长调控机制
Wnt、SHH(sonichedgehog)、Notch途径,也往往调控干细胞的生长分化,提示机体一生中细胞的生长分化由相似的生长调控机制调节,其异常可引起细胞过度增殖,导致肿瘤。 TSC与干细胞有相同的起源:我们知道,侧脑室室管膜下层与海马齿状回是神经干细胞的起源地。通过神经祖细胞与其他祖细胞癌基因神经纤维瘤病1与p53抑癌基因突变,可以制造小鼠脑肿瘤模型。这些模型小鼠产生不同的脑肿瘤。影象学研究表明,这些脑肿瘤虽然可以在广泛的脑内区域产生,但这些肿瘤都起源于侧脑室与海马。

编辑本段
TSC理论对目前肿瘤临床的影响
肿瘤基础与临床
TSC理论可以解释临床上肿瘤对放射治疗与化疗药物治疗不敏感的原因。正常干细胞拥有排出化疗药物的分子泵,对化疗药物敏感性低。TSC与正常干细胞一样,比较分化细胞有更好抵御化疗与放射治疗的能力。
TSC理论认为,肿瘤一开始就有转移能力,只要TSC到达一个新的区域,转移将不可避免。【肿瘤干细胞】
TSC理论对肿瘤诊断与预后判断的影响
慢性粒细胞白血病中肿瘤细胞的CD38阳性率大于20%的患者,其病情往往处于进展期;而CD38阴性的患者预后较好 。
恶性程度高的成神经管细胞瘤与胶质母细胞瘤比较恶性程度较低的星形细胞瘤含TSC的比例要高一些。Clarke指出,极度恶性的乳腺癌,其TSC的比例可达到肿瘤细胞总数的25%。
前列腺早期干细胞突变形成的肿瘤会表达一些神经内分泌标志,象嗜铬粒蛋白A(CgA),但不表达特异性前列腺抗原(PSA) ;源于分化晚期的前列腺干细胞产生的肿瘤细胞表达PSA,而不是CgA。以此类推,源于分化中期干细胞的前列腺癌会同时表达CgA和PSA。 针对TSC进行靶向肿瘤治疗【肿瘤干细胞】
传统的化疗药物主要是通过筛选能杀灭分裂中肿瘤细胞的化合物。TSC理论认为,只要存在TSC,肿瘤就不可能治愈。所以,肿瘤治疗的焦点是杀伤TSC。但是TSC通常处于静止状态,只是在增殖时才开始快速分裂产生子细胞,所以,按照传统方法筛选出来的肿瘤治疗药物与杀灭TSC的要求差异巨大。针对TSC治疗肿瘤已经取得一定的进展:在80%前列腺癌中表达的特有标记前列腺干细胞抗原,是前列腺癌治疗很好的靶点。静脉注射前列腺干细胞抗原单克隆抗体治疗前列腺癌,可以延长荷瘤小鼠的存活时间,并基本抑制前列腺癌肺转移;针对肿瘤干细胞的重要位点Bmi1进行肿瘤免疫治疗的研究也正进行中。
移植技术
使用分子芯片技术,可分析TSC与他们相应成体干细胞基因表达特征的不同。利用这种差异,可能会出现既直接针对TSC,又能保护成体干细胞的治疗手段; 自体造血干细胞移植中,通过TSC的特征标记,可以去除污染的TSC。
结语
目前,在血液肿瘤、乳腺癌、脑肿瘤及前列腺癌中,TSC研究取得了一定的进展。但是,各种TSC的鉴定与分离、TSC特征以及TSC与成体干细胞的确切关系,迫切需要通过一些严谨而富有想象力的实验进行探索。TSC理论是肿瘤基础与临床理论上的突破,必将对肿瘤发生、发展的了解,以及肿瘤的临床诊断、治疗都带来深远的影响
肿瘤干细胞(二)
肿瘤干细胞的分选技术
肿瘤干细胞的分选技术
引言
肿瘤干细胞是在最近的十年间成为癌症研究的热点领域的,然而它并非是一个全新的概念,最早关于肿瘤干细胞的假设可以溯源至百年以前。虽然最近数十年间也有对肿瘤中存在“干细胞”的推断,但长时间地停留在没有充分实验证据支持的假说阶段。直到上世纪九十年代,Dick和他的同事们分离纯化出CD34+CD38-表型的白血病肿瘤细胞,才首次验证了肿瘤干细胞的理论。肿瘤干细胞的发现是肿瘤和干细胞领域多年研究积累、汇集的成果,而其中有一项实验技术的贡献非常关键,也即本章所讨论的细胞分选技术。
众所周知,肿瘤并非是一群混沌的细胞,而更像是一个畸形的器官,构成肿瘤的细胞群体非常地多样和复杂,也即肿瘤异质性理论所表述的内容。然而,要将肿瘤的各个细胞群体分离出来研究其特性,缺少细胞分选技术的介入恐怕是非常困难的。事实上,肿瘤干细胞的研究更好地诠释了肿瘤的异质性,并且也可能是肿瘤领域将细胞分选技术运用得淋漓尽致的典范。细胞种类不同,分选技术的内容也是非常丰富,因为细胞分选就是基于细胞的各种特性。目前分选技术的运用大致可以归入这样几类:一、针对细胞的物理特性,比如细胞的大小,密度,粘附性,折光性,携带电荷等,包括密度梯度离心,荧光激活细胞分选和细胞电泳等方法;二、针对细胞的表面抗原表型,通常可以采用荧光激活细胞分选、免疫吸附和免疫磁珠分离法;三、针对细胞的功能特性,如染料外排,钙离子浓度,pH,荧光蛋白表达,目前最常用的是依靠荧光激活细胞分选。本章内容将简介常规细胞分选的工作流程,重点介绍目前应用较多的分选策略。
一/ 肿瘤样本取材和细胞分离
无论采用何种分选方式,分选之前的工作内容是相似的。流程的第一步是从获得肿瘤标本。绝大部分研究的样本都采集自外科手术,因此应获得伦理机构的许可和患者的知情同意文件,并记录患者的详细资料和核实最终的病理诊断结果。一般认为,从手术中获得的样本到细胞分选的时间越短越好,故取材时必须与手术医生配合良好,取得标本后应尽早置于低温(4°C或冰上)。通常在肉眼下,即可观察到肿瘤各部分组织具有一定异质性,取材应获取代表性的瘤块,并尽量避开坏死的区域。样本可浸入RMPI1640和M199等培养基或Hank’s平衡盐溶液,可参考所研究肿瘤的特性选取。一般情况下,低Ca2+浓度可减少细胞损伤和细胞间粘附,有利于下一步细胞分离;另外,HEPES缓冲体系多用来平衡体外环境的pH,抗生素的加入可以抵抗可能的污染。这样取得的样本一般可直接进入实验室行下一步分选,亦有研究者采取先异种移植到免疫缺陷的NOD/SCID小鼠然后再行细胞分选的策略。
细胞分选的必要条件是制备单细胞悬液并尽可能地保留细胞的活力和功能
状态,这一点对血液肿瘤不是问题,而对实体肿瘤而言可能是主要障碍。不同肿瘤采用的分离手段都不尽相同,但一般采用机械分离加酶消化的方法。瘤块可以置于低温Hank’s液中充分洗涤并用锋利的器械切割成2~4 mm的小块,然后将小瘤块至于37°C含有消化酶的培养基中并适当的振荡,同时保持稳定O2、CO2和pH。酶的使用至关重要,不恰当地使用可能导致细胞无法分离或是消化过度,而后者的结果可能是细胞表面蛋白的丢失和细胞损伤。一般常用酶的消化能力由强到弱的排序依次是胰蛋白酶(Trypsin),木瓜蛋白酶(Papain),弹性蛋白酶(Elastase),透明质酸酶(Hyaluronidase),胶原酶(Collagenase)II、I、IV、III,离散酶(Dispase)和脱氧核糖核酸酶(DNase)I。各种消化酶,各有优缺点,一般来说,效果较强的酶可能造成细胞损伤,效果较弱的酶对细胞损伤相对较小。粗制的酶效果较强,选择性差,精制的酶效果较弱,特异性好,毒性小。从近年的文献报道来看,组织分离中胰蛋白酶使用较少,而胶原酶使用较多,尤其对细胞表面受体损伤较小的IV和III型胶原酶。另外胶原酶可以联合其他的酶使用以发挥最好的效果,如透明质酸酶可以增加结缔组织细胞间基质的解离,离散酶可以促进成纤维细胞的解离等。胶原酶的作用时间可以很长,可大于48小时,但近来文献多报道酶的作用时间在2-4小时,以肿瘤类型不同而有所差异,在肝癌组织中(IV型胶原酶100IU/ml)甚至有15分钟见效的报道。酶作用之后的组织消化液一般需要通过40-100 μm的筛网以除去未消化完全的团块,沉淀细胞,除去上清,使细胞重悬于合适的培养基或平衡盐溶液。操作过程要注意动作轻柔,沉淀细胞可以通过重力沉降或低速离心的方法,但需注意高速离心可能造成脆弱的细胞破裂。收集到的细胞可以做计数和做活性染色,可以得到细胞的得率和存活率,这通常是必要的,有助于整个实验过程的质量控制。事实上,分离得到的细胞的得率和存活率通常是不可兼得,只能追求一个合适的平衡点。对于肿瘤干细胞的研究而言,对细胞的活力的要求是相当苛刻的,因为这将直接影响成瘤实验的结果。
二/ 荧光激活细胞分选
流式细胞仪的基本原理
流式细胞术 (flow cytometry)是一种检测流体状态下的细胞或颗粒特征的技术,它可以在细胞流通过光电检测装置时实时地分析细胞的多个参数,包括细胞大小,颗粒度,荧光染色,免疫荧光标记等。荧光激活细胞分选 (Fluorescence-activated cell sorting,FACS)则是特殊的流式细胞术,需要在专门的流式细胞仪上进行细胞分选的操作,流式细胞仪种类很多,图1是其中一种可用于细胞分选、分析的大型流式细胞仪。
图1 Beckman Coulter 公司Epics Altra型流式细胞分选分析系统
荧光激活细胞分选术是融合了光学,物理学,电子学和生物学多个学科知识的产物,其研发历经二十余年,到目前还在不断地改进以适应生物医学研究的需要。流式细胞分选仪基本可以分为三大系统,即流体学系统 (fluidics)、光学系统 (optics)和电子系统 (electronics),其产生也是由这三部分的技术并行地发展而造就的。读者可以通过回顾流式细胞分选仪的发展历程来了解其系统的构造和细胞分选的原理。
流体系统的基本作用是带动单个细胞快速地通过检测器并把相应的细胞从中分离出来,该系统的发明和目前仍广为使用的Coulter血球计数仪密切相关。Coulter机器体现了现代流式细胞仪的几个基本思想:把细胞的特征(通过Coulter裂孔测得的电阻代表细胞体积)转化为电信号,快速并逐一检测单个细胞,并自动化地处理大量的细胞信号。有趣的是,当时Coulter机器上检测到血液中存在两群体积大小不同的红细胞,Fulwyler等为了研究红细胞是否大小均一的问题时想到了首次采用了分选红细胞的办法,并造就了第一台流式细胞仪的原型(同时证明了红细胞双峰现象是伪象)。他在Coulter计数仪上引入了喷墨打印机的喷墨技术,其基本原理仍然沿用至今:高频振荡的喷嘴,将流动室流出的水柱断裂成均匀的水滴(drop),根据Coulter 机器所检测的细胞大小的信号来使包含特定细胞的水滴带电,再利用偏转板形成的高压电场使其下落方向发生偏转,并落入相应的收集管中。另外,Crosland-Taylor利用层流原理,让微小的细胞流束包裹在大量鞘液流中,从而使其“聚焦”于整个流体的中央,使细胞快速、单个地流动,解决了多个细胞同时通过检测口带来错误信号的问题。至此,这两个发现奠定了流体细胞分选的基石。
然而,Coulter机器并没有真正的发展成为实用的流式细胞分选仪,可能的原因也许是它仅仅只能获得细胞体积的信号,应用的范围受到了限制。在生物医学研究中,
用显微镜来仔细观察细胞的形态特征并获得非常精细的图像显然是最
经典的方法,但是要用这种方式来分析记录大量的细胞的特征则耗时费力。事实上,早在Coulter机器之前,很多学者就在考虑用一种“流式系统”来弥补光学显微镜动态能力上的不足,而且随着荧光染料和单克隆抗体研究的发展,这种需求终于促成了现代流式细胞仪的诞生。上世纪六十年代以后,洛斯阿拉莫斯实验室的Marvin Van Dilla和斯坦福大学的Herzenberg 教授各自引入了光学及电子系统的设计发明了用荧光来检测分选细胞的方法,荧光激活细胞分选这个术语即是由Herzenberg 教授创造,而他也因在这个领域的重要贡献获得2006年京都奖。概况的说,流式细胞仪的光学和电子系统的工作方式就是将激光束持续入射到液流中,当细胞或颗粒快速通过激光束时,会产生前向散射光(Forward scatter)、侧向散射光 (Side scatter)和多种波长的荧光,这些光信号经过透镜和滤镜组之后被光电倍增管等电子系统分别接收并转换为电子脉冲。而分选系统再根据这些信号和操作时的设定参数(门的设置)决定给特定细胞的液滴带上不同的电荷使其被分选出来(图2)。
图2 流式分析原理图
荧光激活细胞分选的应用是非常广泛,因为细胞流式术可以检测的细胞的多种参数,如细胞的大小(前向散射光)、细胞的颗粒度(侧向散射光)、荧光染料的染色深浅、免疫荧光的抗体标记和细胞内的荧光蛋白量等。从分选的方式上来讲,可以正性选择(阳性标记的细胞),可以负向选择(阴性标记的细胞),亦可以同时选择两个甚至多个细胞群体(视具体机器功能)。再肿瘤干细胞的分选中,应用较为广泛的是利用免疫表型的分选和利用Hoechst 33342拒染特性的侧群细胞分选。
免疫表型的荧光染色
免疫表型检测是从血液学和免疫学研究中发展起来,原理就是用荧光染料偶联的抗体标记细胞膜表面的分化抗原。通常免疫荧光标记的方式包括直接标记和间接标记,一般流程如图3所示.具体的细节由分选的细胞和操作者的习惯有所不同,本章中着重介绍实际操作中的一些体会与经验,与同行交流、供读者参考。
图3 免疫表型的荧光染色流程【肿瘤干细胞】
首先,一般来说,整个抗体标记反应必需在冰浴上进行,洗涤、离心等步骤也要保持低温。这样有助于增加细胞的存活率,而且低温下细胞膜的内吞活动大大减少,有利于抗原表位的检测。细胞始终处于合适的平衡盐缓冲液如Hank’s液,磷酸盐缓冲液等,其中添加适度(2%)的血清可以减少细胞损伤和损失。承载细胞悬液的容器宜选择聚丙烯材质的离心管,可以减少频繁离心洗涤过程中细胞.....
的损失。
其次,封闭液中要包含第二抗体宿主(动物)的免疫球蛋白,主要防止细胞表面Fc段的受体非特异性的吸附抗体,这对血液中的单个核细胞尤其重要,长期培养的实体瘤细胞系可以视具体情况而定。如果用间接法标记,第二抗体应尽量选择F(ab’)2段的抗体。
再次,一般情况下,直接标记法操作简单,染色效果更佳,也更有利于保持细胞活性,但是在多色标记的情况下,研究者务必先考虑好联合使用的方案(主要是针对拟使用的流式细胞仪的激光器、
荧光通道选择可以搭配使用的不同荧光
肿瘤干细胞(三)
干细胞和肿瘤干细胞
干细胞和肿瘤干细胞:
干细胞和肿瘤干细胞的相同点:
肿瘤干细胞和干细胞
http://m.zhuodaoren.com/shenghuo355914/
推荐访问:肿瘤干细胞的来源 肿瘤干细胞研究院








